Starsze przeglądarki internetowe takie jak Internet Explorer 6, 7 i 8 posiadają udokumentowane luki bezpieczeństwa, ograniczoną funkcjonalność oraz nie są zgodne z najnowszymi standardami.
Prosimy o zainstalowanie nowszej przeglądarki, która pozwoli Ci skorzystać z pełni możliwości oferowanych przez nasz portal, jak również znacznie ułatwi Ci przeglądanie internetu w przyszłości :)




![Domowe przełamanie Sygnału Lublin w starciu z LKS Stróża [zdjęcia]](https://cdn01.dziennikwschodni.pl/media/news/2024/2024-04/be2135830b8911bd14b48dfc32699c02_std_crd_120.jpg)

![The Reds najlepsi w rozgrywkach Pod Koszami Dziennika Wschodniego [zdjęcia]](https://cdn01.dziennikwschodni.pl/media/news/2024/2024-04/a0c426a3d129564742863ec404ce676d_std_crd_120.jpg)
![Edach Budowlani przegrali z Orkanem i muszą bronić czwartej pozycji [zdjęcia]](https://cdn01.dziennikwschodni.pl/media/news/2024/2024-04/ec16f208e7371f5bf929e6c72a158fd8_std_crd_120.jpg)

![W Lublinie odbyły się mistrzostwa Europy w taekwon-do [zdjęcia]](https://cdn01.dziennikwschodni.pl/media/news/2024/2024-04/bca891045249f349399b6b5cd3bc9303_std_crd_120.jpg)








![A może futbol australijski? Lubelskie „Szerszenie” rekrutują [zdjęcia]](https://cdn01.dziennikwschodni.pl/media/news/2024/2024-04/a00bb7714682872a1393ee520f5ff140_std_crd_120.jpg)







![Świdniczanka lepsza od Podlasia. „Rozdajemy łatwe bramki” [zdjęcia]](https://cdn01.dziennikwschodni.pl/media/news/2024/2024-04/1cee928fab854e6627e528d7f22f0de3_std_crd_120.jpg)





![Bogdanka LUK Lublin pożegnała się z halą Globus w wielkim stylu [zdjęcia kibiców]](https://cdn01.dziennikwschodni.pl/media/news/2024/2024-04/ca274eab9c627c1c9e9a5998326626fc_std_crd_120.jpg)



W jednej wiosce natknął się na oznakowany radiowóz, ale minął go i pojechał dalej. W drugiej namierzyli go policjanci z wideorejestratorem. A że jechał zdecydowanie za szybko, to nie uszło mu to na sucho.

Reprezentacja z 2 Lubelskiej Brygady Obrony Terytorialnej została wicemistrzem w biegu na orientację. Mundurowi musieli wykazać się w sprincie, sztafecie czy w odczytywaniu mapy.
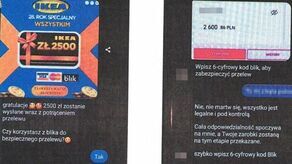
Miała wygrać, a straciła. 52-latka padła ofiarą oszustów działających metodą "na nagrodę w konkursie Ikea".

Datę dziewiątego maja powinni zapisać w swoich kalendarzach wszyscy, którzy kochają grać w piłkę i marzą o karierze sportowej. Właśnie tego dnia Górnik Łęczna organizuje dni otwarte w swoim Liceum

Jeszcze tylko do środy potrwa festiwal Restaurant Week. W tym wydarzeniu na Lubelszczyźnie udział bierze 20 restauracji.

Szukasz restauracji w Lublinie, które warto odwiedzić? Zajrzyj do artykułu i znajdź garść inspiracji na smaczny rodzinny obiad, szybki i świeży lunch na trasie zwiedzania bądź romantyczną kolację ze swoją drugą połówką. Zapraszamy do lektury!

Studenci wydziału Budownictwa i Architektury Politechniki Lubelskiej z okazji Dnia Ziemi budowali ekologiczne ławeczki z palet. Posłużą im one w trakcie przerw.

Ponad rok temu Łuków zawarł umowę z kolejową spółką na remont nieczynnego dworca PKP. Od tego czasu nic się nie dzieje. Ale kolej ma już pewien konkret.

Opadł bitewny kurz walki o samorządy, a na horyzoncie kolejna bitwa. Tym razem o miejsca w parlamencie europejskim. Po przerwie do Brukseli chce wrócić prof. Mirosław Piotrowski. Był już europosłem przez 3 kadencje z poparcia Ligi Polskich Rodzin oraz Prawa i Sprawiedliwości. Tym razem kandyduje z listy Konfederacji. Z jakimi szansami na sukces? Zapraszamy do obejrzenia.

Wszyscy pragną czuć się bezpiecznie w czterech ścianach swojego domu czy mieszkania. Nic więc dziwnego, że wiele osób inwestuje w dodatkowe zabezpieczenia swoich posesji. Wśród najczęściej stosowanych urządzeń, prawdziwy prym wiedzie wideodomofon.

Usługi wykonywane przez profesjonalistów

Radzyńska policja zatrzymała nietrzeźwego kierowcę Opla, który wyprzedzał inny pojazd tuż przed przejściem. Oprócz wysokiego mandatu, może długo posiedzieć za kratkami.

Wybór idealnego rowerka dla dziecka do podjęcia decyzji, który może mieć wpływ na rozwój motoryczny i z jazdy wstępnej. Rower nie tylko zapewnia bezpieczeństwo, ale także zapewnia równowagę i podstawowe bezpieczeństwo. W tym artykule omówimy kluczowe aspekty, które należy uwzględnić przy zakupie rowerka dziecięcego, aby zapewnić wygodę użytkownika, bezpieczeństwo i ilość gier.

Podróżna tłumaczyła, że to zwyczajne kamienie ozdobne, które miały wypełnić jej akwarium. W Terespolu udaremniono przemyt 8 kg Czaroitu.

To wielka szansa do rozwoju dla lubelskich przedsiębiorstw prowadzących badania i wprowadzających innowacje do istniejących produktów, usług czy procesów. Najnowszy nabór organizowany przez Lubelską Agencję Wspierania Przedsiębiorczości w Lublinie dzięki środkom z Unii Europejskiej pozwoli przedsiębiorcom na zrealizowanie ich kolejnych, ambitnych planów.

Szyna CPM, czyli Continuous Passive Motion, to specjalne urządzenie medyczne, które pomaga w leczeniu urazów stawów oraz po operacjach ortopedycznych. Może wydawać się skomplikowane, ale tak naprawdę jest to dość proste urządzenie, które ma za zadanie pomagać w powrocie do zdrowia.

Buyer persona to taki rodzaj fikcyjnej postaci, którą tworzysz, aby lepiej zrozumieć potrzeby i zachowania Twoich klientów. Może się wydawać to skomplikowane, ale tak naprawdę jest to narzędzie, które pomaga Ci lepiej dopasować swoje produkty lub usługi do oczekiwań klientów.

Instalacja zbiornika na deszczówkę przy gospodarstwie domowym może przynieść różne korzyści – zarówno te ekologiczne, jak i ekonomiczne. Przed zdecydowaniem się na taki krok należy jednak zapoznać się z prawnymi aspektami, które dotyczą, m.in. bezpieczeństwa i opłat. Co więc warto wiedzieć?

Uśmiech stanowi wizytówkę niemal każdego człowieka. To właśnie dzięki niemu jesteśmy w stanie wyrażać emocje takie jak radość czy szczęście. Co więcej, zdrowy uśmiech uznawany jest za naprawdę atrakcyjny element ludzkiego wyglądu.































Gracze z całej Polski i nie tylko, w ubiegły weekend zjechali się do Lublina, aby wspólnie rywalizować!

Wiele osób nawet nie zdaje sobie sprawy z tego, jakie finansowe ryzyko niesie za sobą korzystanie z nowoczesnego smartfona bez jakiejkolwiek formy protekcji obudowy bądź wyświetlacza. Zwłaszcza w tych drogocennych modelach ryzyko uszkodzenia mechanicznego może być wysokie. Identycznie, jak ewentualny koszt naprawy rozbitego ekranu czy tylnej obudowy urządzenia.

Malediwy stały się niemal synonimem luksusowego wypoczynku w tropikach. Ponad 1000 większych i mniejszych wysepek zebranych w 26 atolach na wodach Oceanu Indyjskiego to miejsce jakby wyjęte z pocztówki. Plaże pokryte jasnym piaskiem, błękit oceanu, zieleń palm i zagajników, a w tym wszystkim ukryte kameralne resorty i hotele. Tu można prawdziwie odpocząć i zrelaksować się z dala od codzienności.



























































































































